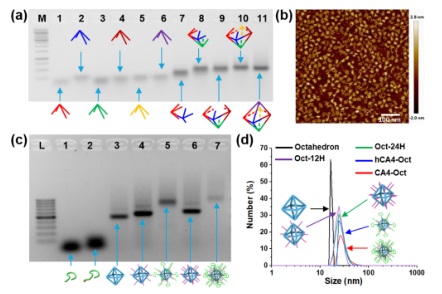
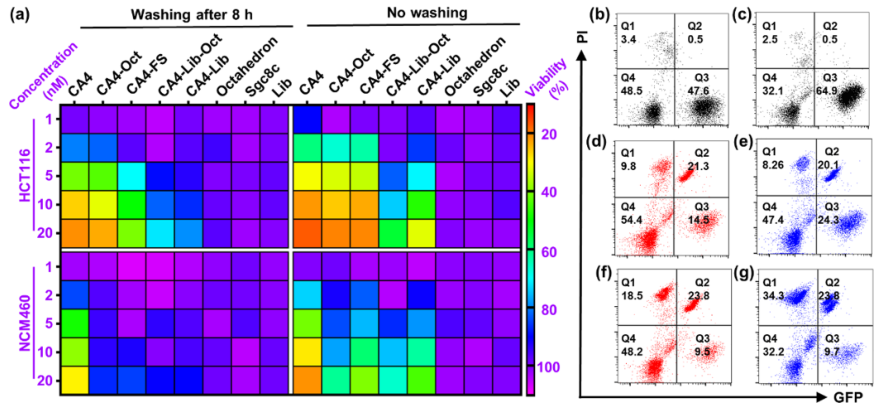
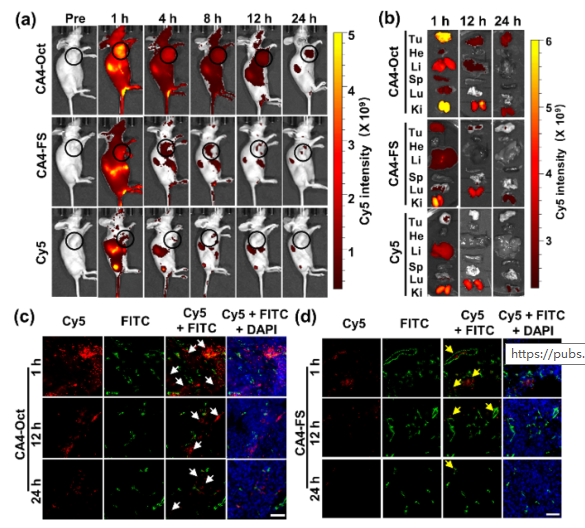
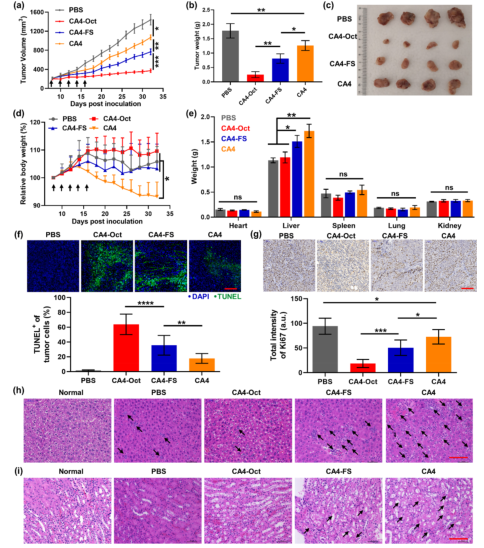
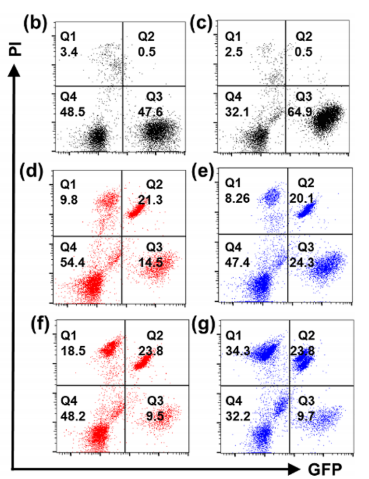
疏水小分子化疗药物的系统分布和非靶向细胞毒性导致副作用和疗效降低,阻碍了其在癌症治疗中的广泛应用。由于包括有机聚合物、无机纳米颗粒、脂质体等药物载体的快速发展,许多靶向给药策略已经建立起来,以克服这些缺点。然而,这些合成材料的生物相容性低,降解性差和具有一定的免疫原性风险。大多数纳米药物载体,尤其是聚合物体系,总体分子量和大小难以控制,导致药物与载体的比例不均,重现性低。靶向给药的这些内在问题阻碍了其在精确医学和临床试验中的广泛应用。 由于DNA纳米结构的尺寸和几何形状易于预先设计和构建,它们在生物传感、生物成像、药物控制释放和智能纳米医学等领域得到了广泛的应用。为了提高与靶细胞的接触机会,三维DNA纳米结构表现出更好的可调性和结合能力。DNA折纸被认为是DNA结构纳米技术的重大突破,因为它可以轻松控制大小、形状和3D几何形状。许多DNA折纸结构已经被开发用于多重有效载荷和刺激反应药物释放。然而,内源性核酸酶降解的不稳定性和数百个未使用的短链的高成本阻碍了DNA折纸转化为临床试验。DNA多面体纳米结构具有良好的可编程性、精确的寻址性和明确的空间定向性,为分子医学作为药物载体在理想位置精确功能化药物提供了一个有前景的平台。 DNA四面体和其他多面体骨架因其易于自组装、高度耐核酸酶稳定性和良好的内化作用而被广泛报道。通过利用这些因子,各种小分子药物、反义寡核苷酸和siRNA被这些多面体纳米结构装载,以增强细胞摄取、治疗效果和生物安全性。基于有限的可编程性和载药能力不足的典型的DNA四面体(由四个ssDNA组成),谭蔚泓院士及其团队在本文中报道了一个创新的纳米结构的设计和应用:由DNA八面体线框和CA4(广谱微管抑制剂)功能化的Sgc8c寡核苷酸适配子(CA4-FS)组成。多个CA4分子可以整合在一个核酸适配体功能化的八面体DNA纳米载体中,为靶向癌症治疗提供了良好的CA4传递,可用于精确的癌症成像和有效的靶向治疗。 基本信息 题目: 期刊:ACS Nano 影响因子:14.588 通讯作者:谭蔚泓,柯勇刚和王雪强为共同通讯作者 作者单位:湖南大学和美国埃默里大学 索莱宝合作产品: 产品名称 产品货号 ANNEXIN V- FITC/PI 凋亡检测试剂盒 摘 要 虽然小分子药物在癌症治疗中起着至关重要的作用,但小分子药物的固有问题,如溶解性差和系统性毒性,大大降低了它们的抗癌功能,并造成了副作用。为了达到令人满意的治疗效果,必须开发创新的靶向系统,以保证抗癌药物精确、高效地递送。在本研究中,作者采用分层自组装策略来制备由DNA八面体线框和化学药物功能化的Sgc8c适配体组成的核-壳纳米结构。DNA纳米结构的高渗透长滞留效应和Sgc8c适配体的主动靶向能力,使得高选择性化疗药物递送和体内高效成像和治疗成为可能。作者的多功能纳米结构的优势进一步体现在其血清稳定性、优异的积累能力、深穿透能力、显著提高的治疗效果和良好的生物安全性。这项研究显示了这种核-壳DNA纳米结构在精确药物装载控制、药物传递和个性化用药方面的潜力。 研究内容及结果 1.DNA八面体线框的分层自组装 作者首先获得了单链CA4-FS,接下来通过分层自组装策略构建了一个DNA八面体。采用可编程退火的方法,构建了6个四通连接DNA块作为DNA八面体的顶点。然后DNA块通过它们的单链结构域连接在一起,形成一个DNA八面体线框。优化了构建条件后,验证了由DNA块逐步组装的DNA八面体(图1a)。AFM成像证实了八面体的形态(图1b)。为了证明药物负载的可调性,作者构建了具有不同手柄数的DNA八面体用于与CA4-FS杂交。 图1 这种DNA八面体的可寻址性和可预见性允许精确地装载不同数量的单链CA4-FS。作为概念验证,作者构建了半负载CA4-八面体(hCA4-Oct)和全负载CA4-Oct,并测定了负载效率(图1c)。为了进一步验证hCA4-Oct和CA4-Oct的可编程组装,作者接下来分别用Cy3标记的Oct-12H、Cy3标记的Oct-24H和Cy5标记的CA4-FS研究了CA4-Oct的荧光共振能量转移(FRET)效应。正如预期的那样,hCA4-Oct和CA4-Oct均显示出明显的FRET信号。八面体水动力尺寸为17.0±1.1nm,功能Oct-12H和Oct-24H的水动力尺寸分别为24.9±3.0和26.5±3.4nm。hCA4-Oct的大小为29.5±3.2nm,CA4-Oct的大小为30.1±3.7nm(图1d)。AFM成像也证实了hCA4-Oct和CA4-Oct的形成。这一结果表明CA4-FS指向DNA八面体核的外侧,形成三层核-壳纳米组装体。上述结果证明了在DNA八面体上可以精确地装载多个游离药物分子。 2.细胞内化与肿瘤球体穿透 为了最大限度地负载CA4-FS,接下来的研究选择了一个完全负载CA4修饰的DNA八面体。图2a,b结果证明了通过修饰DNA纳米结构上的适配体增强了细胞内化。竞争性阻断实验也支持了这一结论。CA4-Oct的位移大于CA4-FS。基于上述结果,作者推断,内化增强的因素有:(i)识别单元增加(24 CA4-FS vs 1 CA4-FS);(ii)八面体结构的刚度;(iii)提高CA4-Oct的稳定性。对于稳定性因子的重要作用,作者测试了CA4-Oct和CA4-FS在10%胎牛血清中的生物稳定性。8小时处理后,CA4-Oct保持不变,但55%的CA4-FS被降解。所以CA4-Oct的内化速率比CA4-FS的内化速率要快(图2b)。CA4-Oct和CA4-FS在无FBS培养基中保持了相同的完整性,表现出了相同的时间依赖性内化速率,进一步说明了至关重要的稳定因子减缓了CA4-FS的时间依赖性内化。 为了研究细胞选择性,作者还检测了PTK7阴性的NCM460细胞(正常结直肠细胞系)。与NCM460细胞相比,CA4-Oct和CA4-FS对HCT116细胞的吸收更多(图2c)。值得注意的是,与单链CA4-FS相比,CA4-Oct对HCT116细胞和NCM460细胞间CA4传递的细胞内化选择性要大得多(图2d)。可视化共聚焦成像也证实了上述发现。这些结果表明CA4-Oct比单链CA4-FS具有更多的细胞内化和选择性。为研究CA4在实体肿瘤组织中的递送深度,制备HCT116三维多细胞肿瘤球形体。与单链CA4-FS相比,CA4-Oct在肿瘤球状体中心有更高的强度(图2e)。这些发现支持了适配体壳由于其识别和结合作用而起主导作用的假说,以及DNA八面体核促进CA4-FS在肿瘤组织中的插入。 图2 3.靶向性细胞毒性和稳定性 在鉴定了CA4-Oct的细胞内化和穿透能力后,作者测定了其对目标癌细胞的细胞毒性。为了研究适配体介导的靶向给药的影响,作者选择了8h的短期孵育和40h的额外孵育,将抗癌功能从非特异性细胞吸附和核溶解中分离出来。作者发现,对照组Sgc8c、Lib、CA4-Lib、DNA八面体和CA4-Lib-Oct对HCT116细胞没有或可忽略的细胞毒性(图3a)。正如预期的那样,CA4-Oct比CA4-FS对HCT116细胞表现出更高的抑制细胞毒性。为了进一步强调CA4-Oct的细胞特异性毒性,作者还比较了对HCT116和NCM460细胞的毒性。如图3a所示,在孵育48小时后(预处理8小时后洗),除CA4外,所有组对NCM460细胞都没有表现出或可以忽略不计的细胞毒性。基于这些结果,CA4-Oct通过包裹CA4-FS表现出对肿瘤细胞的选择性,从而表现出选择性细胞毒性。 接下来,作者将培养时间增加到48小时,以评估DNA序列潜在的不稳定性介导的降解所导致的脱靶风险的可能性。基于图3a研究结果,作者认为显著提高CA4-Oct的核酸酶抗性可以显著缓解单价CA4-FS的脱靶效应,从而获得更好的安全性。 为了进一步系统地揭示CA4-Oct的靶向细胞毒性,作者构建了细胞共培养系统,模拟药物对体内多细胞共存环境的现实影响。在本研究中分别用CA4-Oct或CA4-FS处理转染了GFP的HCT116(GFP阳性)和NCM460(GFP阴性)的共培养体系(1:1,Q3/Q4,图3b)。在未经任何处理的孵育4h后,由于癌细胞的恶性增殖,活癌细胞与正常活细胞的比率(RCN)约为2:1(图3c)。短期治疗(8h冲洗后),CA4-Oct组RCN变为1:4,CA4-FS组RCN仅为1:2(图3d,e)。除抑制增殖外,CA4-Oct杀死约60%的HCT116细胞,而CA4-FS仅杀死45%((Q2/(Q2+Q3),图3d,e)。同时,CA4-FS和CA4-Oct导致正常细胞凋亡率较低(Q1/(Q1+Q4),图3d,e)。在长期治疗(不洗涤)中,CA4-FS杀死了52%的NCM460细胞,尽管它诱导了71%的HCT116细胞凋亡(图3g)。然而,CA4-Oct也能杀死71%的HCT116细胞,但仅能引起28%的NCM460细胞凋亡(图3f)。因此,CA4-FS和CA4-Oct的RCNs分别约为1:3和1:5。显然,由于细胞外血清稳定性的差异,CA4-FS的脱靶不良反应比CA4-Oct严重的多。这些结果表明,DNA八面体增强了肿瘤细胞的靶向细胞毒性,降低了正常细胞的不稳定性介导的脱靶风险。 图3 4.活体成像分析 在良好的体外表现的鼓舞下,作者实施了体内评估。首先,将Cy5标记的CA4-Oct、Cy5标记的CA4-FS和游离的Cy5分别静脉注射到SD大鼠,通过追踪眼眶静脉血荧光信号来评价它们的药代动力学。补充实验结果支持Cy5在体内实验中未出现超出说明以外的实验现象,携带CA4的CA4-Oct比单链CA4-FS的血液浓度和循环时间要高得多。 CA4-FS组在注射后4和8小时肿瘤部位显示出更亮的Cy5信号,但在注射后12小时显示出非常微弱的荧光信号(图4a)。但CA4-Oct组在注射后第1天荧光信号仍然很亮。同时处死小鼠进行离体分析,评价其生物分布。静脉给药后12h,Cy5和CA4-FS主要分布在肾脏,而CA4-Oct在肿瘤部位表现出超过24h的强烈荧光信号(图4b)。 为了进一步确定CA4-Oct在实体瘤组织中是否具有优越的聚集能力和穿透能力,作者收集CA4-Oct组和CA4-FS组的肿瘤组织进行切片分析。CA4-Oct组在各实验时间点的Cy5信号均比CA4-FS组更亮(图4c,d),说明CA4-Oct具有更强的聚集能力,能够将更多的CA4药物传递到肿瘤组织。从CA4-FS与FITC标记的血管生物标志物CD31共定位结果来看,CA4-FS大多数分布在肿瘤血管内部或周围(图4d)。相比之下,大多数CA4-Oct穿过肿瘤血管,到达肿瘤组织(图4c),这将有利于深部给药。多价、致密、刚性的CA4-Oct确实增强了单链CA4-FS的穿透能力及其在实体肿瘤组织中的治疗潜力。 图4 5.体内靶向癌症治疗 图像表征完成后,作者在HCT116荷瘤异种移植小鼠中进行了抗肿瘤实验,未发现溶血现象。经5次静脉给药(接种肿瘤后第18天),CA4-Oct、CA4-FS、CA4组的肿瘤生长抑制率分别达到86%、65%、46%(图5a)。但一旦停止给药,CA4-Oct的抑瘤率仍维持在85%左右,而CA4-FS组和CA4组的抑瘤率进一步下降,分别降至54%和30%(第32天)。这可能是由于CA4-Oct渗透深度较深,滞留时间较长所致。此外,体外肿瘤重量和肿瘤图像均表明CA4-Oct是作为靶向药物的最佳选择(图5b,c)。为了评估治疗的安全性,作者首先监测了这些小鼠的体重变化。由于全身分布的副作用,CA4处理的小鼠体重明显减轻(约7%)(图5d)。与CA4-Oct组相比,CA4-FS组体重增长也下降了6%。第32天取脏器称重,评价药物对健康组织的可能损伤。与PBS组和CA4-Oct组相比,CA4和CA4-FS组肝脏异常增重更为严重(图5e)。对这个解毒器官的损害可能是归因于CA4-FS的脱靶毒性和CA4的非选择性毒性。为了进一步阐明CA4-Oct治疗的有效性和安全性,作者采集肿瘤组织、主要脏器和血液进行更详细的研究。CA4-Oct显示TUNEL阳性细胞(TUNEL+)有约65%的凋亡,而CA4-FS和CA4仅显示35%和20%的杀伤能力(图5f)。与CA4-FS组和CA4组相比,增殖标记Ki67信号显示CA4-Oct对肿瘤增殖的抑制作用最强(图5g)。 接下来作者也采集了相同条件下未接种肿瘤的正常小鼠的正常器官和血液。首先,作者研究了可能的肝毒性,因为CA4可以引起肝痛。与未接种肿瘤的正常组相比,PBS组肝内淋巴细胞轻微浸润,但给药CA4-Oct减轻了这种趋势(图5h)。PBS和CA4-Oct均未显示明显的肝细胞死亡。CA4-FS组肝细胞局部坏死,肝星状细胞增生。在小鼠肝脏中央静脉周围观察到局部淋巴细胞浸润(图5h)。更严重的是CA4给药后肝细胞大面积斑片状坏死,HSCs增生更为明显。CA4组可见许多中性粒细胞和淋巴细胞浸润区,丙氨酸转氨酶和天冬氨酸转氨酶异常升高也证实了这一趋势。这些结果显示CA4-FS和CA4的肝毒性水平不同,而CA4-Oct显示出一定的潜在安全性。 图5 然后作者评估各组肾脏的HE染色切片的组织病理学。与正常组比较,PBS组与CA4-Oct无明显差异(图5i)。然而,CA4-FS给药后,可以看到肾小管刷状缘局灶性脱落和轻微的细胞肿胀。在游离CA4组中,除了明显的细胞脱落和肿胀外,还发现血清肌酐明显升高,间质水肿伴炎性细胞浸润(图5i)。这些结果表明,适配体修饰缓解了CA4的肾脏损伤,而DNA八面体保护CA4-FS免于靶CA4外溢至肾脏组织。 作者继续检查其他的生化和血液学数据。与正常组和PBS组比较,CA4-Oct组CK无明显升高,而CA4-FS组和CA4组CK有不同程度升高。说明CA4-FS和CA4可造成不同程度的心脏损伤。也有报道称游离CA4可引起血小板减少症。CA4确实导致血小板明显减少,但CA4-FS和CA4-Oct组未见损伤。另一个不一致的指标是白细胞(WBCs)的数量。令人惊讶的是,与正常组相比,CA4-Oct组的WBCs没有明显升高,而PBS、CA4-FS和CA4组的WBCs明显升高。这些发现进一步说明PBS、CA4-FS和CA4可能导致潜在的炎症和骨髓抑制。只有CA4-Oct的抗癌方案可以获得最有效的治疗,且具有足够的生物安全性。不幸的是,作者并没有从心脏、肝脏和脾脏的HE切片评估中发现CA4-Oct的其他优势。此外,除CA4外,其他各组均未诱导免疫反应指标明显升高。 结 论 为了解决小分子药物治疗癌症的问题,作者设计了一种创新的DNA线框纳米结构,它由DNA八面体和CA4-FS组成。本研究利用固相合成技术制备CA4-FS,并利用DNA分层自组装技术构建具有外向手柄数可控的DNA八面体。通过编程加载过程,多个CA4-FS可以准确地附着在DNA八面体上,形成一个三维核-壳纳米结构。DNA八面体纳米载体结构紧凑、刚性强,与5’端和3’端暴露的灵活适配体载体相比,具有更高的耐核酶稳定性。由于DNA手柄的功能化,该DNA纳米结构显示出精确和高容量的药物装载控制性能。同时,DNA线框纳米载体重塑了单链CA4-FS的性质,具有更好的生物稳定性、更高的细胞内化、优异的成像特性和更深的穿透肿瘤深度,从而获得更有效的肿瘤成像和靶向治疗。综上所述,这种基于分层自组装的具有药物定位功能的八面体DNA为肿瘤靶向治疗和精准医学提供了一个有效和有前景的平台。 索莱宝产品亮点 相关产品 产品名称 产品货号 优级胎牛血清(无噬菌体低内毒素) RPMI Medium 1640(含双抗) 4%组织细胞固定液 高效RIPA裂解液(组织/细胞) Hoechst 33342/PI双染试剂盒 Anti-MKI67 Polyclonal Antibody Anti-MKI67 Polyclonal Antibody DAPI溶液(即用型)



文献解读|分层组装的DNA线框纳米结构,可用于癌症高效成像和靶向治疗
作者:北京索莱宝科技有限公司 2021-01-11T14:32 (访问量:4352)
北京索莱宝科技有限公司 商家主页
地 址: 北京市通州区中关村科技园区通州园金桥科技产业基地景盛南四街15号85A三层
联系人: 索莱宝-龚思雨
电 话: 010-50973130
传 真:
Email:3193328036@qq.com
相关咨询
喜讯|索莱宝荣获专精特新“小巨人”称号 (2024-11-22T00:00 浏览数:2654)
索莱宝年终盛典,岁末回馈特惠来袭! (2024-11-22T00:00 浏览数:2798)
群贤毕至,共襄盛举|索莱宝精彩亮相2024全国植物生物学大会 (2024-11-22T00:00 浏览数:2916)
载誉而归,闪耀未来|索莱宝2024慕尼黑上海分析生化展圆满收官 (2024-11-22T00:00 浏览数:3009)
慕尼黑上海生化展,索莱宝在N4-4526等你! (2024-11-20T00:00 浏览数:4992)
新品早知道—同位素标记小分子化合物上线啦~ (2024-11-20T00:00 浏览数:5044)
抗体产品星推荐第二十二期|Anti-GNB1 Polyclonal Antibody (2024-11-20T00:00 浏览数:4413)
细胞骨架标志物 (2024-11-19T00:00 浏览数:6033)
文献解读|基因可编程细胞膜伪装纳米颗粒用于靶向联合治疗结肠直肠癌 (2024-11-19T00:00 浏览数:5932)
9月文献回顾|索莱宝产品书写科研新辉煌,共绘创新新篇章 (2024-11-18T00:00 浏览数:4825)
